|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Молекулы как элементы устройств памяти, логики и отображения информации
Потенциальная логика на молекулах
Уже простейшие молекулы могут выполнять функции логических элементов. Это убедительно показано, например, в роботах [Yan L., Seminario J.M. Moletronics Modeling Toward Molecular Potentials. – International Journal of Quantum Chemistry. – 2004. – V. 104. – P. 1964–1969; Yan L., Seminario J.M. Cascade Configuration of Logical Gates Processing Information Encoded in Molecular Potentials. – International Journal of Quantum Chemistry. – 2007. – V. 107. – P. 754–761]. Используя вычислительные методы квантовой механики, авторы рассчитали связывающие МО для молекулы, структурная формула которой показана на рис. 4.7,а. А зная распределение электронной плотности в молекуле, они рассчитали затем и распределение вокруг нее электрического потенциала.
Группы  на двух длинных концах молекулы считались входами (Вход 1 и Вход 2), а этиленовая группа
на двух длинных концах молекулы считались входами (Вход 1 и Вход 2), а этиленовая группа  на коротком конце – выходом. Когда на входах создавался положительный электрический потенциал, например, от расположенных возле входов молекул воды (обведены пунктиром), то связывающие молекулярные орбитали несколько сдвигались в направлении этих входов. Соответственно сдвигались и связывающие молекулярные орбитали также и на коротком конце молекулы в направлении от выхода. В результате на выходе тоже возникал положительный электрический потенциал.
на коротком конце – выходом. Когда на входах создавался положительный электрический потенциал, например, от расположенных возле входов молекул воды (обведены пунктиром), то связывающие молекулярные орбитали несколько сдвигались в направлении этих входов. Соответственно сдвигались и связывающие молекулярные орбитали также и на коротком конце молекулы в направлении от выхода. В результате на выходе тоже возникал положительный электрический потенциал.
На рис. 4.7,б в качестве примера показано рассчитанное на компьютере распределение электрического потенциала вокруг молекулы воды: слева – вид в плоскости молекулы воды, справа – в проекции сбоку. Атом кислорода изображен большим темным шариком, атомы водорода – меньшими белыми шариками. Распределение потенциала является типичным для электрического диполя.
На
рис.
4.8 показаны результаты расчетов эквипотенциальных поверхностей вокруг молекулы  для 4-х случаев. Распределение (а) получено для электрически изолированной молекулы. Возле каждой эквипотенциальной кривой указан соответствующий электрический потенциал в вольтах. В окрестности ионов водорода, расположенных на концах молекулы, имеем положительные электрические потенциалы, свидетельствующие о том, что связывающие молекулярные орбитали имеют наибольшую электронную плотность между атомами водорода и углерода, так что ионы водорода экранированы этими МО не полностью.
для 4-х случаев. Распределение (а) получено для электрически изолированной молекулы. Возле каждой эквипотенциальной кривой указан соответствующий электрический потенциал в вольтах. В окрестности ионов водорода, расположенных на концах молекулы, имеем положительные электрические потенциалы, свидетельствующие о том, что связывающие молекулярные орбитали имеют наибольшую электронную плотность между атомами водорода и углерода, так что ионы водорода экранированы этими МО не полностью.
Распределение (б) имеем в случае, когда возле входа 1 (на рисунке он внизу) расположена молекула воды так, что атом кислорода обращен ко входу, т.е. на вход 1 действует отрицательный полюс электрического диполя. А другая молекула воды, расположенная возле входа 2 (вверху), сориентирована атомами водорода к нему, т.е. на вход 2 действует положительный полюс диполя. Связывающая МО возле входа 1 сдвигается в сторону атома углерода, а возле входа 2 – в сторону атома водорода. Несколько изменяется распределение потенциала и возле выхода, однако потенциал на выходе остается положительным.
Распределение (в) имеем в случае, когда возле обоих входов молекулы воды расположены так, что атом кислорода обращен ко входу, т.е. на оба входа действует отрицательный полюс электрического диполя. Связывающие МО возле входов несколько сдвигаются в сторону атомов углерода, и в результате этого МО возле выхода сдвигаются в сторону атомов водорода. Распределение потенциала возле выхода существенно изменяется. Потенциал здесь становится отрицательным.
Распределение (г) имеем в случае, когда возле обоих входов молекулы воды расположены так, что ко входам обращены атомы водорода, т.е. на оба входа действует положительный полюс электрического диполя. Связывающие МО возле входов сдвигаются в сторону атомов водорода, и в результате этого МО возле выхода сдвигаются в сторону атома углерода. Потенциал возле выхода остается положительным.
Если принять, что положительный (высокий) потенциал на входе/выходе кодирует логическую "1", а отрицательный (низкий) потенциал – логический "0", тогда описанная молекула формирует на выходе "1", когда хотя бы на один вход подана логическая "1", т.е. молекула действует как логический элемент "ИЛИ" (дизъюнкция).
Если же, наоборот, считать положительный потенциал на входе/выходе за логический "0", а отрицательный потенциал – за логическую "1", тогда описанная молекула формирует на выходе "1" лишь в том случае, когда на оба входа поданы логические "1", т.е. молекула действует как логический элемент "И" (конъюнкция). Потенциалы на выходе по величине практически такие же, как на входах.
Показано, что при построении каскадов из таких логических элементов, когда выход предыдущего элемента расположен рядом и действует на вход следующего молекулярного логического элемента, смещение уровней потенциала практически отсутствует. Так что логические цепи из таких молекул можно продолжать без промежуточного усиления. Молекулы функционируют при этом как потенциальные логические элементы.
Время "переключения" таких логических элементов определяется временами перестройки молекулярных орбиталей и исчисляется десятками фемтасекунд, т.е. составляет порядка 10-14 с при совсем незначительном рассеянии энергии (порядка 0,5 эВ на одно переключение).
Но вот надежно выполнять логическую операцию отрицания, используя только деформации и сдвиг молекулярных орбиталей, не удается. Для этого нужны "активные" молекулярные элементы типа молекулярных транзисторов, о которых мы расскажем позже.
Электропроводность молекул и контактов металла с молекулой
Иной подход к применению молекул как логических элементов состоит в использовании способности некоторых из них проводить электрический ток. Сейчас известно уже много групп таких молекул, некоторые из них показаны на
рис.
4.9. Для упрощения в точках стыка отрезков-связей группы СН здесь не показаны, их наличие считается само собой разумеющимся. Кроме 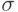 -связей, в них присутствуют также
-связей, в них присутствуют также  -связи (условно изображенные чередующимися одинарными и двойными черточками). Электроны, находящиеся на МО, образующих эти связи, (далее будем обозначать такие молекулярные орбитали через
-связи (условно изображенные чередующимися одинарными и двойными черточками). Электроны, находящиеся на МО, образующих эти связи, (далее будем обозначать такие молекулярные орбитали через  -МО), "размазаны" по всей молекуле, "обобществлены". Обычно связывающая
-МО), "размазаны" по всей молекуле, "обобществлены". Обычно связывающая  -МО целиком заполнена – в том плане, что на ней нет свободных мест. Поэтому электроны, которые находятся на ней, не могут получить импульс направленного движения и не могут переносить заряд.
Но если молекула размещена между двумя металлическими электродами (
рис.
4.10 слева), выполняющими роль "резервуаров" электронов, то при наличии внешнего электрического напряжения появляется возможность протекания электрического тока. На
рис.
4.10 справа показана соответствующая энергетическая диаграмма. Здесь
-МО целиком заполнена – в том плане, что на ней нет свободных мест. Поэтому электроны, которые находятся на ней, не могут получить импульс направленного движения и не могут переносить заряд.
Но если молекула размещена между двумя металлическими электродами (
рис.
4.10 слева), выполняющими роль "резервуаров" электронов, то при наличии внешнего электрического напряжения появляется возможность протекания электрического тока. На
рис.
4.10 справа показана соответствующая энергетическая диаграмма. Здесь  – уровень Ферми для электронов в металле; HOMO (от англ. highest occupied molecular orbitals) - полностью заполненная электронами
– уровень Ферми для электронов в металле; HOMO (от англ. highest occupied molecular orbitals) - полностью заполненная электронами 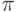 -МО; LUMO (от англ. lowest unoccupied molecular orbitals) – ближайшая свободная
-МО; LUMO (от англ. lowest unoccupied molecular orbitals) – ближайшая свободная 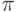 -МО, не заполненная электронами.
-МО, не заполненная электронами.

Рис. 4.9. Химическая структура некоторых полимерных молекул, способных проводить электрический ток: 1 – полиацетилен; 2 – полифенилен; 3 –полипирол; 4 – политиофен; 5 – полианилин

Рис. 4.10. Условное изображение системы "металл – молекула – металл" (слева) и ее энергетическая диаграмма (справа)
Электроны с HOMO под действием приложенного электрического поля получают возможность переходить на анод (эти переходы на диаграмме обозначены цифрой 1), перенося отрицательный электрический заряд. При этом на HOMO образуется незаполненная вакансия – "дырка". Эта "дырка" имеет возможность двигаться к катоду (цифра 2), перенося положительный электрический заряд. Возле катода на свободное место может перейти электрон 3. Кроме того, в металле есть некоторое количество электронов 4, которые за счет энергии теплового движения могут преодолеть небольшой потенциальный барьер и перейти в молекулу на свободную 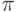 -МО (LUMO). Вдоль этой свободной
-МО (LUMO). Вдоль этой свободной 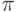 -МО такие электроны могут двигаться к аноду. Все это вместе и создает электрический ток сквозь молекулу.
-МО такие электроны могут двигаться к аноду. Все это вместе и создает электрический ток сквозь молекулу.
У молекул, имеющих заметную электропроводность, энергетическое расстояние 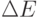 между HOMO и LUMO относительно невелико, – как между валентной зоной и зоной проводимости в полупроводниках. Поэтому сплошной мономолекулярный слой таких молекул, расположенный между металлическими слоями, с точки зрения электропроводности ведет себя как слой полупроводника.
между HOMO и LUMO относительно невелико, – как между валентной зоной и зоной проводимости в полупроводниках. Поэтому сплошной мономолекулярный слой таких молекул, расположенный между металлическими слоями, с точки зрения электропроводности ведет себя как слой полупроводника.
Если в такой (как на
рис.
4.9) молекуле заменить один из боковых атомов водорода на группу 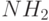 , то, поскольку энергия электронов на связывающей МО этой группы выше, чем энергия электронов на HOMO, они под действием тепловой активации значительно легче переходят на LUMO, повышая электропроводность молекулы. Соответствующая энергетическая диаграмма показана на
рис.
4.11 слева. Это похоже на появление донорной примеси в полупроводнике.
, то, поскольку энергия электронов на связывающей МО этой группы выше, чем энергия электронов на HOMO, они под действием тепловой активации значительно легче переходят на LUMO, повышая электропроводность молекулы. Соответствующая энергетическая диаграмма показана на
рис.
4.11 слева. Это похоже на появление донорной примеси в полупроводнике.
Если же заменить один из атомов водорода на группу 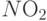 , то, поскольку энергия электронов на свободной МО этой группы ниже, чем энергия электронов на LUMO, электроны с HOMO значительно легче переходят на МО такой группы, высвобождая "дырку" на HOMO и тоже повышая электропроводность молекулы (
рис.
4.11 справа).
, то, поскольку энергия электронов на свободной МО этой группы ниже, чем энергия электронов на LUMO, электроны с HOMO значительно легче переходят на МО такой группы, высвобождая "дырку" на HOMO и тоже повышая электропроводность молекулы (
рис.
4.11 справа).
Это похоже на появление акцепторной примеси в полупроводнике. Такие химические модификации позволяют регулировать электропроводность описанных молекул в широких границах – вплоть до квазиметаллической.
Энергетическая диаграмма, показанная на
рис.
4.11 справа, является некоторым упрощением. На самом деле 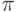 -МО, как правило, непосредственно не прилегает к металлу (на диаграмме это показано небольшими серыми промежутками). Контактируют с ним другие, "концевые" МО, например связывающая МО ковалентной связи "
-МО, как правило, непосредственно не прилегает к металлу (на диаграмме это показано небольшими серыми промежутками). Контактируют с ним другие, "концевые" МО, например связывающая МО ковалентной связи "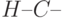 " или МО, образующая ковалентную связь "
" или МО, образующая ковалентную связь "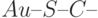 ". Здесь могут возникнуть относительно высокие потенциальные барьеры для электронов, и тогда электроны переходят с
". Здесь могут возникнуть относительно высокие потенциальные барьеры для электронов, и тогда электроны переходят с 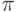 -МО в металл и обратно путем туннелирования сквозь этот, относительно тонкий (~ 0,1 нм) потенциальный барьер.
-МО в металл и обратно путем туннелирования сквозь этот, относительно тонкий (~ 0,1 нм) потенциальный барьер.
Эксперименты показывают, что малое переходное сопротивление на контакте "золото – молекула" наблюдается в случае ковалентной связи "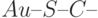 ", когда атом золота (
", когда атом золота ( ) не выделен (не выступает из металла, а органически встроен в соответствующий электрод). Еще меньшее переходное сопротивление удалось получить, реализовав ковалентную связь одного из атомов углерода из бензольного кольца непосредственно с платиной (
) не выделен (не выступает из металла, а органически встроен в соответствующий электрод). Еще меньшее переходное сопротивление удалось получить, реализовав ковалентную связь одного из атомов углерода из бензольного кольца непосредственно с платиной ( ).
).



