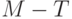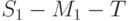| Россия |
Теоретические основы работы люминесцентных сенсоров. Хронофлуорометры
Цель лекции: напомнить слушателям основные сведения о люминесценции. Объяснить теоретические основы и широкие возможности метода индукции флуоресценции хлорофилла для изучения процессов фотосинтеза в зеленых листьях растений, для контроля здоровья и развития растений, для их селекции, управления урожайностью, для наблюдений с помощью отобранных растений за состоянием окружающей природной среды. Ознакомить с устройством и функционированием современных интеллектуальных хронофлуорометров. Предложить достаточно полный обзор выпускаемых сейчас интеллектуальных хронофлуорометров и их возможностей.
21.1. Общие сведения о люминесценции
Напомним, что люминесценцией называют вызванное каким-то возбуждающим фактором избыточное (над тепловым) излучение тел, которое запаздывает относительно возбуждения на время, значительно больше периода световых колебаний.
В зависимости от причины возбуждения атомов или молекул различают:
- фотолюминесценцию, которая возникает в результате поглощения возбуждающего света;
- рентгенолюминесценцию, возникающую в результате возбуждения рентгеновским излучением;
- катодолюминесценцию, которая возникает в результате бомбардировки быстрыми электронами;
- электролюминесценцию, которая возникает в результате возбуждения электрическим полем или током;
- биолюминесценцию, возникающую в результате возбуждений, возникающих при протекании биохимических реакций и других биологических процессов в живом организме;
- хемилюминесценцию, которая возникает в результате возбуждений при химических реакциях, и т.п.
Каждый из этих видов люминесценции может быть использован для построения разнообразных люминесцентных сенсоров.
По времени задержки люминесценции относительно возбуждения различают такие ее виды, как флуоресценция и фосфоресценция. При флуоресценции время задержки очень мало (не больше условной границы в 1 мс). Она достаточно быстро затухает после прекращения возбуждения. При фосфоресценции, наоборот, задержка и затухание люминесценции после прекращения возбуждения очень значительны – больше условной границы в 1 с. Иногда фосфоресценция продолжается в течение многих десятков часов. Люминесценция с промежуточными значениями задержки во времени (между 1 мс и 1 с) специального названия не имеет. Изменения задержки люминесценции относительно возбуждения могут нести ценную информацию об объекте наблюдения.
Спектральный состав люминесценции зависит от свойств излучающего тела и при фотолюминесценции, например, отличается от спектрального состава возбуждающего света. Энергия квантов люминесценции обычно меньше энергии, полученной атомом, молекулой или кристаллом в результате возбуждения. Поэтому, скажем, спектр фотолюминесценции всегда сдвинут относительно спектра возбуждающего излучения в сторону красной области спектра. Изменения в спектральном составе люминесценции также могут быть первичным информационным сигналом в интеллектуальном сенсоре.
Интенсивность флуоресценции, как правило, пропорциональна интенсивности возбуждения (например, интенсивности возбуждающего света, интенсивности рентгеновского облучения, силе тока электронного пучка и т.п.). Интенсивность эта может зависеть от ряда внешних факторов. Например, с повышением температуры интенсивность флуоресценции, как правило, уменьшается. Это явление называют температурным тушением люминесценции. Некоторые факторы, наоборот, могут благоприятствовать люминесценции, интенсивность которой возрастает. Поэтому, измеряя интенсивность люминесценции, можно получить информацию о наличии и поведении каждого из таких "факторов".
Люминесценцию уже давно применяют для выявления дефектов в изделиях, для исследования художественных полотен, свойств кристаллов, выявления примесей, для считывания невидимых без специального возбуждения штрих-кодов или маркировок и т.п.
Наблюдение, измерение и анализ люминесцентного излучения биологических объектов может давать много ценной информации о состоянии и функционировании этих объектов. Рассмотрим один из важных для практики примеров.
21.2. Теоретические основы метода индукции флуоресценции хлорофилла
Одним из фундаментальных процессов жизнедеятельности растений является фотосинтез – образование под действием света углеводов, глюкозы и других органических веществ из молекул воды и углекислого газа с выделением кислорода. Именно фотосинтез является главным источником наращивания биомассы на планете, очищения атмосферы Земли от углекислого газа и обогащения её кислородом. В этом отношении совсем не является преувеличением утверждение о том, что фотосинтез лежит в основе всей жизни на Земле.
По тому, насколько эффективно происходит в растениях фотосинтез, можно судить об их здоровье и о состоянии окружающей среды, определять оптимальные условия произрастания, прогнозировать дальнейшее развитие растений и их плодородие. Нарушения в фотосинтезе начинаются, как правило, еще задолго до того, как изменится внешний вид растения. Обнаружив нарушения фотосинтеза, можно еще на ранней стадии выявить заболевания растений, ухудшение состояния окружающей среды и своевременно помочь растениям, проведя соответствующие агротехнические мероприятия (увлажнение, подкормку, обработку против болезней и т.п.).
21.2.1. Краткие сведения о механизме фотосинтеза
К сожалению, сами растения не могут сразу же сообщить нам о том, что им стало плохо. Но живая природа оставила нам возможность, которая позволяет с помощью интеллектуальных сенсоров своевременно выявить нарушения фотосинтеза. Чтобы объяснить эту возможность, напомним вкратце механизм фотосинтеза [ [ 186 ] , [ 263 ] , [ 300 ] , [ 316 ] ].
Первичными для этого процесса являются акты поглощения света в хлоропластах молекулами хлорофилла и других биологических пигментов ("светосборщиков"), которые обеспечивают эффективное собирание на нужды фотосинтеза энергии из почти всего спектра дневного света. Электронные возбуждения, которые возникают в результате поглощения света, передаются на так называемые "реакционные центры" хлоропластов. Доставленная сюда энергия возбуждения может быть использована:
а) на стимулирование фотохимических реакций;
б) на флуоресценцию в красной области спектра;
в) на безизлучательную диссипацию с преобразованием энергии возбуждения в тепловую энергию.
Безизлучательная диссипация определяется в основном температурой листьев и мало зависит от эффективности расходования энергии на фотосинтез. Таким образом, биохимические реакции фотосинтеза и флуоресценция являются конкурирующими каналами утилизации собранной энергии возбуждения. Чем больше поглощенной в хлоропластах световой энергии идет на фотосинтез, тем меньше интенсивность флуоресценции хлорофилла. И, наоборот, если фотосинтез тормозится, угнетается какими-то факторами, тогда возрастает интенсивность флуоресценции хлорофилла. Таким образом, флуоресценция хлорофилла – это "изобретенный" и предоставленный нам природой механизм сигнализации о ходе фотосинтеза в живом хлоропласте.
Известно, что фотосинтез – это сложный многостадийный биохимический процесс. Сначала ряд так называемых "световых" реакций в хлоропластах и находящихся в них молекулах хлорофилла обеспечивает перенос в два этапа (на т.н. "фотосистемах І и ІІ") валентных электронов от молекул воды (ионов гидроксила) к молекулам НАДФ (никотинамидадениндинуклеотидфосфата) – одному из важных промежуточных ферментов фотосинтеза, с повышением их энергии. В переносе электронов принимают участие и ряд других промежуточных ферментов. Дальше происходит ряд так называемых "темновых" реакций фотосинтеза, известных под названием "цикла Кальвина", в ходе которых происходит синтез углеводов с поглощением молекул углекислого газа (СО2) и выделением молекул кислорода (О2), и фосфорилирование аденозиндифосфорной кислоты (АДФ).
21.2.2. Единицы измерения интенсивности освещения при фотосинтезе
Для хода процессов фотосинтеза важна не столько суммарная энергия поглощенного света, сколько количество поглощаемых квантов света за единицу времени. Ведь фотосинтез, как и фотоэффект, – это сугубо квантовый физико-химический процесс. Поэтому интенсивность возбуждающего фотосинтез света принято выражать в квантовых единицах – в "молях фотонов на квадратный метр площади за секунду" (мольx м–2с–1). Такая интенсивность означает, что на квадратный метр поверхности каждую секунду падает 1 моль, т.е. 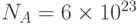 (число Авогадро) фотонов видимого света. Энергия одного фотона с длиной волны
(число Авогадро) фотонов видимого света. Энергия одного фотона с длиной волны 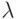 = 500 нм cоставляет
= 500 нм cоставляет  Дж.
Если приять это за среднюю энергию фотонов всего видимого света, тогда интенсивность 1 мольx м–2с–1 эквивалентна энергетическому потоку 240 кВт/м2. Это – весьма мощный поток. Поэтому чаще пользуются квантовой единицей интенсивности в миллион раз меньшей – 1 мкмоль фотонов/(м2с), которая эквивалентна энергетическому потоку 240 мВт/м2 или в единицах освещенности приблизительно 140 люкс (лк).
Дж.
Если приять это за среднюю энергию фотонов всего видимого света, тогда интенсивность 1 мольx м–2с–1 эквивалентна энергетическому потоку 240 кВт/м2. Это – весьма мощный поток. Поэтому чаще пользуются квантовой единицей интенсивности в миллион раз меньшей – 1 мкмоль фотонов/(м2с), которая эквивалентна энергетическому потоку 240 мВт/м2 или в единицах освещенности приблизительно 140 люкс (лк).
Указанные соотношения для видимого света, возбуждающего фотосинтез,
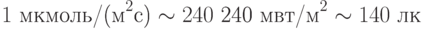 |
( 21.1) |
Уровень квантовой интенсивности возбуждающего света в 20  500 мкмоль/(м2с) считают физиологически нормальным. Квантовую интенсивность света до 10 мкмоль/(м2с) считают низкой. Интенсивность порядка 2000 мкмоль/(м2с) и выше называют "насыщающей", поскольку она достаточна для быстрого восстановления всех первичных акцепторов электронов, т.е. для полного насыщения квантами возбуждения всех каналов фотосинтеза.
500 мкмоль/(м2с) считают физиологически нормальным. Квантовую интенсивность света до 10 мкмоль/(м2с) считают низкой. Интенсивность порядка 2000 мкмоль/(м2с) и выше называют "насыщающей", поскольку она достаточна для быстрого восстановления всех первичных акцепторов электронов, т.е. для полного насыщения квантами возбуждения всех каналов фотосинтеза.
21.2.3. Индукция флуоресценции хлорофилла
Если зеленый листок продолжительное время (15  45 мин.) выдержать в темноте, то все запасы возбуждений (активированных молекул и ионов, в том числе ферментов) исчерпываются, и фотосинтез прекращается. Когда на такой адаптированный к темноте живой листок начинает действовать свет, то на реакционные центры хлоропластов направляется поток электронных возбуждений. В начальный момент все каналы фотосинтетического переноса электронов полностью открыты, они максимально интенсивно "откачивают" энергию в цепь реакций фотосинтеза, и флуоресценция хлорофилла минимальна. Ее интенсивность в этот момент обозначают F0. Собранная энергия возбуждений в основном идет на восстановление первичных акцепторов электронов.
Концентрация еще не восстановленных первичных акцепторов начинает уменьшаться. Из-за этого замедляется откачка электронных возбуждений на фотосинтез, вследствие чего интенсивность флуоресценции хлорофилла возрастает. В биохимической цепи фотосинтеза по мере накопления активированных молекул-ферментов предыдущего звена начинают активироваться следующие звенья. Весь фотосинтетический процесс развивается (как бы "разворачивается") во времени. А вместе с ним изменяется во времени и интенсивность флуоресценции хлорофилла, сигнализируя о развитии процесса фотосинтеза.
45 мин.) выдержать в темноте, то все запасы возбуждений (активированных молекул и ионов, в том числе ферментов) исчерпываются, и фотосинтез прекращается. Когда на такой адаптированный к темноте живой листок начинает действовать свет, то на реакционные центры хлоропластов направляется поток электронных возбуждений. В начальный момент все каналы фотосинтетического переноса электронов полностью открыты, они максимально интенсивно "откачивают" энергию в цепь реакций фотосинтеза, и флуоресценция хлорофилла минимальна. Ее интенсивность в этот момент обозначают F0. Собранная энергия возбуждений в основном идет на восстановление первичных акцепторов электронов.
Концентрация еще не восстановленных первичных акцепторов начинает уменьшаться. Из-за этого замедляется откачка электронных возбуждений на фотосинтез, вследствие чего интенсивность флуоресценции хлорофилла возрастает. В биохимической цепи фотосинтеза по мере накопления активированных молекул-ферментов предыдущего звена начинают активироваться следующие звенья. Весь фотосинтетический процесс развивается (как бы "разворачивается") во времени. А вместе с ним изменяется во времени и интенсивность флуоресценции хлорофилла, сигнализируя о развитии процесса фотосинтеза.
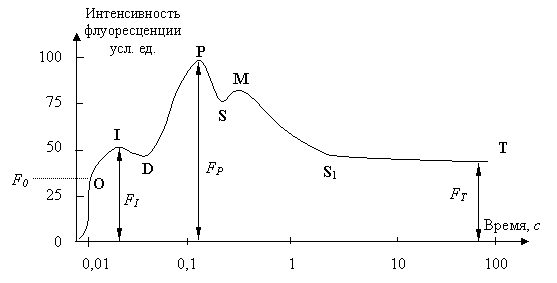
Это явление было открыто еще в 30-х годах прошлого века [ [ 67 ] , [ 79 ] ] и получило название "индукции флуоресценции хлорофилла" (ИФХ). А график зависимости интенсивности флуоресценции хлорофилла от времени, начиная от начала освещения, (см. рис. 21.1) назвали "кривой индукции флуоресценции хлорофилла" ("кривой ИФХ" или же "кривой Каутского" – в честь первооткрывателя).
Среди специалистов принято разбивать её на ряд характерных участков, которые получили уже общепринятые обозначения 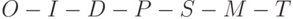 . Вдоль горизонтали использовали логарифмическую шкалу времени в секундах. Вдоль вертикали интенсивность флуоресценции представлена в относительных единицах. Участок
. Вдоль горизонтали использовали логарифмическую шкалу времени в секундах. Вдоль вертикали интенсивность флуоресценции представлена в относительных единицах. Участок 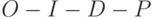 , на котором изменения интенсивности флуоресценции происходят весьма быстро (за доли секунды), называют "быстрой фазой" ИФХ, а участок
, на котором изменения интенсивности флуоресценции происходят весьма быстро (за доли секунды), называют "быстрой фазой" ИФХ, а участок 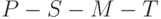 – "медленной фазой" ИФХ.
– "медленной фазой" ИФХ.
Для каждого из участков в табл. 21.1 указаны интервалы времени (после начала освещения), на которых они наблюдаются. Там же указаны и стадии фотосинтетического процесса, которым они соответствуют и которыми регулируются.
Интервалы времени могут существенно различаться для разных видов растений и даже для разных листьев одного растения, которые имеют разный возраст или адаптировались к разным условиям освещения (например, растут возле корней или на кроне, на старых ветвях или на молодых побегах, хорошо освещены или все время затенены). Поэтому в графе таблицы "Интервал времени" приведены по два разных варианта значений, – чтобы был ясен диапазон варьирования.
Интенсивность флуоресценции хлорофилла в главном максимуме (точка 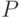 кривой ИФХ) принято обозначать
кривой ИФХ) принято обозначать 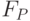 или
или  , а интенсивность в стационарном режиме –
, а интенсивность в стационарном режиме –  . Выход на стационарный режим после второго максимума в точке
. Выход на стационарный режим после второго максимума в точке 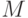 может быть монотонным или же проходить еще через один промежуточный минимум в точке
может быть монотонным или же проходить еще через один промежуточный минимум в точке 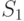 . Для второго случая в табл. 21.1 выделены строки 4,а и 4,б.
. Для второго случая в табл. 21.1 выделены строки 4,а и 4,б.
Богатые информационные возможности метода ИФХ детально проанализированы в [ [ 230 ] , [ 235 ] ]. Они еще более возрастают, когда для исследования, кроме основного источника света, применяют и другие импульсные источники света. В настоящее время индукцию флуоресценции хлорофилла стали понимать в более широком смысле, – как любые изменения интенсивности флуоресценции хлорофилла, вызываемые воздействием внешних факторов.
Ценную дополнительную информацию о процессах фотосинтеза можно также получить, если исследовать их зависимость, например, от температуры или от других факторов, если измерять не только флуоресценцию, но и фосфоресценцию (длительное послесвечение) хлорофилла, а также если дополнить чисто флуоресцентный метод еще и спектральным. В этом случае, например, нацелено возбуждают флуоресценцию отдельных форм хлорофилла светом узкого спектрального интервала и/или измеряют не только интегральную интенсивность флуоресценции, но и интенсивность отдельных ее спектральных составляющих [ [ 260 ] , [ 275 ] ].
Из вышеизложенного вытекает, что методом ИФХ можно на живом растении, без его повреждения определять ряд важных характеристик. Это – квантовые выходы фотосинтеза (фактический и потенциально возможный) и тепловой диссипации энергии, оптимальные условия функционирования фотосинтетического аппарата растения, скорость светового повреждения (в результате слишком интенсивного освещения) и самовосстановления фотосинтетических систем, соотношение между концентрациями разных видов фотосистем и т.п. [ [ 230 ] , [ 235 ] ].
21.2.4. Влияние внешних факторов на кривую ИФХ
Чтобы продемонстрировать чувствительность кривой ИФХ как индикатора изменения физиологического состояния растений и условий окружающей среды, приведем уже хорошо изученное экспериментально влияние некоторых внешних факторов на эту кривую.
1. Повышение температуры внешней среды относительно оптимального для данного вида растений значения вызывает уменьшение величины 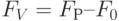 . Причиной является снижение активности электрон-транспортной цепи, т.е. световой стадии фотосинтеза [
[
144
]
]. Исчезает промежуточный пик
. Причиной является снижение активности электрон-транспортной цепи, т.е. световой стадии фотосинтеза [
[
144
]
]. Исчезает промежуточный пик 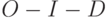 . Наиболее вероятная причина – преобразование части реакционных комплексов фотосистемы
. Наиболее вероятная причина – преобразование части реакционных комплексов фотосистемы 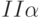 в комплексы
в комплексы 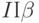 [
[
131
]
].
[
[
131
]
].
При возрастании температуры выше жизненно допустимого уровня (выше 45-50  С) начинает заметно возрастать интенсивность
С) начинает заметно возрастать интенсивность 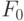 [
[
15
]
,
[
118
]
].
[
[
15
]
,
[
118
]
].
По этим признакам можно, например, быстро (еще не выращивая следующее поколение растений) отбирать сорта и экземпляры растений, более стойкие к жаре.
2. Снижение температуры внешней среды относительно оптимального для данного вида растений значения тоже вызывает уменьшение величины 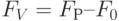 . Причиной является снижение фотохимической активности фотосистемы II. Замедляется рост интенсивности флуоресценции на участке
. Причиной является снижение фотохимической активности фотосистемы II. Замедляется рост интенсивности флуоресценции на участке 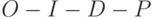 ; возрастает отношение
; возрастает отношение  . Причиной является увеличение концентрации так называемых
. Причиной является увеличение концентрации так называемых 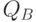 – невосстанавливающих реакционных центров [
[
122
]
]. Здесь
– невосстанавливающих реакционных центров [
[
122
]
]. Здесь  – интенсивность флуоресцеции в точке
– интенсивность флуоресцеции в точке 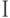 кривой ИФХ. При повреждении листвы холодом исчезает
кривой ИФХ. При повреждении листвы холодом исчезает 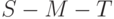 максимум, замедляется
максимум, замедляется  – спад интенсивности флуоресценции [
[
49
]
].
– спад интенсивности флуоресценции [
[
49
]
].
По указанным признакам кривой ИФХ можно быстро отбирать более морозостойкие экземпляры и сорта растений.
3. Засоление почвы приводит к снижению интенсивностей 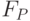 и
и 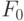 . Наиболее вероятная причина: ускорение миграции поглощенной световой энергии к фотосистемам І [
[
147
]
]. Уменьшается также отношение
. Наиболее вероятная причина: ускорение миграции поглощенной световой энергии к фотосистемам І [
[
147
]
]. Уменьшается также отношение 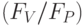 , замедляется
, замедляется  спад интенсивности флуоресценции. Причина: угнетение активности фотосистем ІІ, торможение транспорта электронов [
[
44
]
,
[
123
]
].
спад интенсивности флуоресценции. Причина: угнетение активности фотосистем ІІ, торможение транспорта электронов [
[
44
]
,
[
123
]
].
По указанным признакам кривой ИФХ теперь можно быстро отбирать растения, более стойкие к засолению почвы.
4. Водный дефицит вызывает уменьшение разности интенсивностей 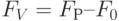 – примерно пропорционально уменьшению водного потенциала листьев. Наиболее вероятная причина – задержка восстановления первичного акцептора фотосистемы ІІ из-за угнетения выделения кислорода, торможение межсистемного переноса электронов [
[
50
]
]. Замедляется спад интенсивности флуоресценции на участке
– примерно пропорционально уменьшению водного потенциала листьев. Наиболее вероятная причина – задержка восстановления первичного акцептора фотосистемы ІІ из-за угнетения выделения кислорода, торможение межсистемного переноса электронов [
[
50
]
]. Замедляется спад интенсивности флуоресценции на участке 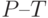 . Вероятная причина: замедление переноса электронов фотосистемой І [
[
42
]
]. Уменьшается (сглаживается) максимум
. Вероятная причина: замедление переноса электронов фотосистемой І [
[
42
]
]. Уменьшается (сглаживается) максимум 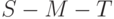 . Причина: заметные изменения в темновом метаболизме, угнетение темновой стадии фотосинтетического процесса [
[
134
]
].
. Причина: заметные изменения в темновом метаболизме, угнетение темновой стадии фотосинтетического процесса [
[
134
]
].
Совокупность указанных признаков можно использовать для целенаправленного отбора засухоустойчивых сортов и экземпляров растений.
Можно приводить и много других примеров влияния изменения условий внешней среды на ход фотосинтеза в зеленых растениях, служащих причиной изменений в кривых ИФХ. И всё это можно использовать для ускорения селекции нужных сортов растений.
Ботаники установили, что практически всегда можно подобрать виды или сорта растений, в которых кривые ИФХ особенно чувствительны к интересующему нас фактору ухудшения окружающей среды. Периодическое наблюдение ИФХ в них может быть эффективным инструментом для непрерывного мониторинга состояния окружающей среды, особенно в т.н. "зонах риска". С помощью соответствующих водорослей, в частности, можно надежно выявлять ухудшение или подтверждать улучшение состояния акваторий (озёр, болот, каналов, рек, морей).


 к Фд и НАДФ) – "световая стадия" фотосинтеза
к Фд и НАДФ) – "световая стадия" фотосинтеза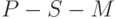
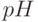 в мембранах, восстановление конкури-рующих акцепторов (
в мембранах, восстановление конкури-рующих акцепторов ( 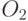 ,
, 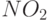 и т.п.)
и т.п.)