|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Свойства молекул, лежащие в основе молекулярной элементной базы информатики
Свойства молекул
Многообразие молекул чрезвычайно велико. Если число видов стабильных атомов характеризуется сотнями (с учетом существования нескольких изотопов у многих химических элементов), то многообразие известных малых и средних молекул достигает уже десятков миллионов. А возможное многообразие таких гигантских молекул, как ДНК, исчисляется числами с сотнями нулей.
Размер молекулы, т.е. размер ее электронной оболочки, из-за размытости молекулярных орбиталей является величиной несколько условной. Практические размеры молекул определяются измерением расстояний, на которые они могут быть сближены при плотной упаковке в молекулярном кристалле или в жидкости. Наименьшие молекулы имеют размер значительно меньше 1 нм, а наибольшие могут иметь длину свыше 1 мкм.
Массу молекул задают обычно в атомных единицах массы (а.е.м., другое название – дальтон):

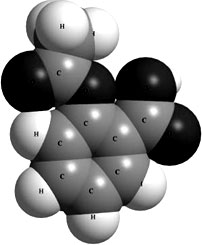
Как мы видели, ковалентные химические связи в молекулах располагаются под определенными углами. Поэтому молекулы имеют определенную пространственную конфигурацию. На
рис.
3.9 для примера показана пространственная модель молекулы  – ацетилсалициловой кислоты (аспирина). Атомы водорода изображены в виде светлых шариков, атомы углерода – в виде серых, кислорода – в виде темных шариков.
– ацетилсалициловой кислоты (аспирина). Атомы водорода изображены в виде светлых шариков, атомы углерода – в виде серых, кислорода – в виде темных шариков.
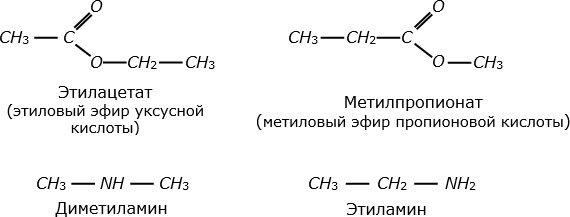
Некоторые молекулы состоят из одинаковых наборов атомов, но различаются их расположением или пространственной ориентацией, и поэтому имеют разные физические и химические свойства. Такие молекулы называют изомерами. Еще в первой половине ХІХ в. было выявлено различие между молекулами  и
и  . Такие изомеры, которые отличаются структурной формулой, называют структурными изомерами. Особенно много структурных изомеров имеют молекулы органических веществ. На
рис.
3.10 показана лишь пара примеров. Молекулы в верхнем ряду различаются лишь порядком расположения одних и тех же групп атомов, а молекулы в нижнем ряду – еще и разной группировкой атомов.
. Такие изомеры, которые отличаются структурной формулой, называют структурными изомерами. Особенно много структурных изомеров имеют молекулы органических веществ. На
рис.
3.10 показана лишь пара примеров. Молекулы в верхнем ряду различаются лишь порядком расположения одних и тех же групп атомов, а молекулы в нижнем ряду – еще и разной группировкой атомов.
Если молекула не имеет ни центра, ни оси, ни плоскости симметрии, то, как правило, существует также молекула, зеркально ей симметричная. Такие молекулы называют стереоизомерами.
Многие из биологически важных веществ могут нормально функционировать лишь в форме одного определенного стереоизомера. Интересной особенностью таких молекул является то, что они обе оптически активны, т.е. слегка поворачивают плоскость поляризации света, проходящего сквозь вещество из таких молекул. Но поворот плоскости поляризации происходит в противоположных направлениях.
Есть молекулы, имеющие практически одинаковые структурные формулы, но различающиеся своей пространственной формой. Такие молекулы называют пространственными (конформационными) изомерами. Пример двух таких молекул показан на
рис.
3.11. Атомы углерода соединены здесь двойной связью. Одну осуществляет молекулярная 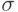 –орбиталь, а другую – молекулярная
–орбиталь, а другую – молекулярная 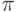 -орбиталь.
-орбиталь.
Существуют молекулы, которые переходят одна в другую при вращении группы атомов вокруг простой молекулярной  –орбитали. Такие изомеры называют поворотными изомерами или конформерами.
–орбитали. Такие изомеры называют поворотными изомерами или конформерами.
Молекулы, как правило, электрически нейтральны, положительный электрический заряд ядер точно скомпенсирован суммарным отрицательным электрическим зарядом электронов. Но "центр тяжести" положительных электрических зарядов далеко не всегда совпадает с "центром тяжести" отрицательных, и потому большинство молекул имеют электрический дипольный момент.
Напомним, что электрический дипольный момент простейшего диполя, состоящего из двух электрических зарядов 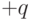 и
и 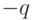 , расположенных на расстоянии
, расположенных на расстоянии 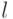 , по величине равен
, по величине равен
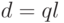 |
( 3.1) |
В системе СИ он измеряется в "кулонах на метр" (Кл?м). Для мира молекул это слишком большая единица. Поэтому для дипольных моментов молекул используют единицу "Дебай":
 |
( 3.2) |
Например, электрический дипольный момент молекулы воды 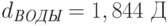 , а дипольный момент одной из наиболее полярных молекул
, а дипольный момент одной из наиболее полярных молекул 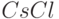 с классической ионной связью
с классической ионной связью  .
.
Дипольный момент является векторной величиной. Вектор этот направлен от положительного заряда к отрицательному.
В молекулах отрицательный заряд валентных электронов распределен по всему объему. Среднее значение дипольного момента молекулы рассчитывают по квантово-механической формуле:
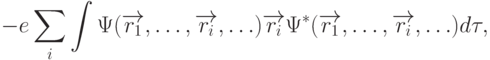 |
( 3.3) |
 – электрический заряд электрона,
– электрический заряд электрона, 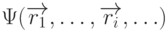 – волновая функция всех электронов молекулы,
– волновая функция всех электронов молекулы, 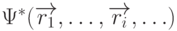 - комплексно сопряженная функция, а интегрирование проводят по многомерному координатному пространству всех электронов молекулы.
- комплексно сопряженная функция, а интегрирование проводят по многомерному координатному пространству всех электронов молекулы.В электрическом поле напряженностью 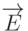 в результате кулоновских взаимодействий на диполь действует момент силы
в результате кулоновских взаимодействий на диполь действует момент силы
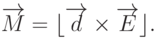 |
( 3.4) |
Этот момент стремится развернуть диполь в направлении силовых линий этого поля. Повернувшись в направлении силовых линий, дипольные моменты молекул усиливают внешнее электрическое поле еще и своим электрическим полем.
У тех молекул, у которых собственного дипольного момента нет ("центры тяжести" положительных и отрицательных электрических зарядов совпадают), под действием внешнего электрического поля происходит "поляризация". Она состоит в том, что молекулярные орбитали электронов деформируются, и "центр тяжести" отрицательных электрических зарядов несколько смещается относительно практически неподвижных положительных электрических зарядов ядер атомов против направления поля. Возникает "наведенный" дипольный момент молекулы.
Спины электронов, которые находятся на молекулярных орбиталях, почти всегда взаимно скомпенсированы. Однако на внутренних электронных оболочках атомов переходных элементов могут находиться электроны с некомпенсированным спином. Могут иметь не скомпенсированные спины также и ядра атомов. Поэтому некоторые молекулы, кроме электрического дипольного момента, имеют также и магнитный момент. Такие молекулы ведут себя в магнитном поле как элементарные "магнитики". Магнитный момент молекул, атомов и отдельных частиц измеряют в магнетонах Бора.
Наконец, большим преимуществом молекул как элементов информатики является то, что все они (имеются в виду молекулы одного типа) одинаковы, тождественны. В то время, как "надмолекулярные" элементы информатики, которые формируются даже с применением самых точных технологий, всегда имеют определенный "разброс" своих характеристик. И при построении из них сложных систем это нередко приводит к значительному уменьшению "выхода годной продукции".